Indhold
- Generelle egenskaber for immunoglobuliner
- Funktioner i de konstante og variable immunoglobulinregioner
- IgA
- IgD
- IgE
- IgG
- IgM
- En note om antistofdiversitet
Immunoglobuliner, også kaldet antistoffer, er glycoproteinmolekyler, der udgør en vigtig del af immunsystemet, som mere generelt er ansvarlig for at bekæmpe infektiøs sygdom og udenlandske "invasioner". Ofte forkortet som "Ig" findes antistoffer i blod og andre kropsvæsker fra mennesker og andre hvirveldyr. De hjælper med at identificere og ødelægge fremmede stoffer, såsom mikrober (f.eks. Bakterier, protosoanparasitter og vira).
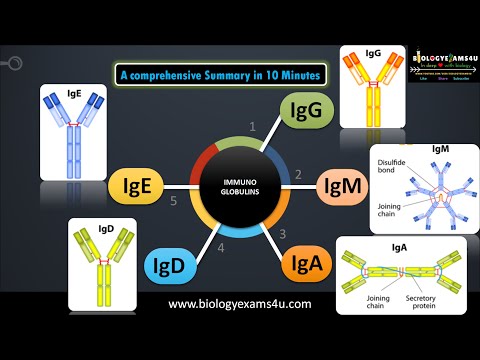
Immunoglobuliner er klassificeret i fem kategorier: IgA, IgD, IgE, IgG og IgM. Kun IgA, IgG og IgM findes i betydelige mængder i den menneskelige krop, men alle er vigtige eller potentielt vigtige bidragydere til den humane immunrespons.
Generelle egenskaber for immunoglobuliner
Immunoglobuliner produceres af B-lymfocytter, som er en klasse af leukocytter (hvide blodlegemer). Det er symmetriske Y-formede molekyler, der består af to længere tunge (H) kæder og to kortere lette (L) kæder. Skematisk inkluderer "stilken" af Y de to L-kæder, der splittes fra hinanden omtrent halvvejs fra bunden til toppen af immunoglobulinmolekylet og divergerer i en ca. 90 graders vinkel. De to L-kæder løber langs ydersiden af Y's "arme" eller dele af H-kæderne over splitpunktet. Således består både stammen (to H-kæder) og begge "arme" (en H-kæde, en L-kæde) af to parallelle kæder. L-kæderne findes i to typer, kappa og lambda. Disse kæder interagerer alle med hinanden via enten disulfid (S-S) bindinger eller brintbindinger.
Immunoglobuliner kan også opdeles i konstante (C) og variable (V) dele. C-delene dirigerer aktiviteter, hvor alle eller de fleste immunglobuliner deltager, mens V-områderne binder til specifikke antigener (dvs. proteiner, der signalerer tilstedeværelsen af en bestemt bakterie, virus eller andet fremmed molekyle eller enhed). Antistoffernes "arme" kaldes formelt Fab-regioner, hvor "Fab" betyder "antigenbindende fragment"; V-delen heraf inkluderer kun de første 110 aminosyrer i Fab-regionen, ikke det hele, da delene af Fab-armene tættest på forgreningspunktet for Y er ret konstante mellem forskellige antistoffer og betragtes som en del af C område.
Analogt skal du overveje en typisk bilnøgle, der har en del, der er fælles for de fleste nøgler uanset det specifikke køretøj nøglen er designet til at betjene (f.eks. Den del, du holder i din hånd, når du bruger den) og en del, der er kun specifik for det pågældende køretøj. Håndtagets del kan sammenlignes med C-komponenten i et antistof og den specialiserede del til V-komponenten.
Funktioner i de konstante og variable immunoglobulinregioner
Den del af C-komponenten under Y-grenen, kaldet Fc-regionen, kan tænkes på som hjernerne i antistofoperationen. Uanset hvad V-regionen er designet til at gøre i en given type antistof, kontrollerer C-regionen udførelserne af dets funktioner. C-regionen for IgG og IgM er det, der aktiverer komplementvejen, som er et sæt ikke-specifik "første forsvarslinje" -immunrespons, der er involveret i inflammation, fagocytose (hvor specialiserede celler fysisk griber fremmedlegemer) og cellenedbrydning. C-regionen af IgG binder til disse fagocytter såvel som til "naturlig killer" -celler; C-regionen af IgE binder til mastceller, basofiler og eosinofiler.
Hvad angår detaljerne i V-regionen, er denne meget varierende strimmel af immunoglobulinmolekylet i sig selv opdelt i hypervariable og rammeregioner. Mangfoldighed i den hypervariable grund, som din intuition sandsynligvis antyder, er ansvarlig for det fantastiske udvalg af antigener, som immunglobuliner er i stand til at genkende, nøgle-i-lås-stil.
IgA
IgA tegner sig for omkring 15 procent af antistofferne i det menneskelige system, hvilket gør det til den næst mest almindelige type immunoglobulin. Kun ca. 6 procent findes i blodserumet. I serum findes det i dens monomere form - det vil sige som et enkelt molekyle i en Y-form som beskrevet ovenfor. I sin sekretorium fra eksisterer den imidlertid som en dimer eller to af Y-monomererne forbundet. Faktisk er den dimere form mere almindelig, da IgA ses i en lang række biologiske sekretioner, herunder mælk, spyt, tårer og slim. Det har en tendens til at være uspecifik med hensyn til de typer udenlandske nærvær, den er målrettet mod. Dens tilstedeværelse på slimhinder gør det til en vigtig gateholder på fysisk sårbare steder, eller de pletter, hvor mikrober let kan finde måder dybere ind i kroppen.
IgA har en halveringstid på fem dage. Den sekretoriske form udgør i alt fire steder, hvor antigener kan bindes, to pr. Y-monomer. Disse kaldes korrekt epitop-bindende steder, da epitopen er den specifikke del af enhver invader, der udløser en immunreaktion. Fordi det findes i slimhinder, der udsættes for høje niveauer af fordøjelsesenzymer, har IgA en sekretorisk komponent, der forhindrer, at den nedbrydes af disse enzymer.
IgD
IgD er den sjældneste af de fem klasser af immunglobuliner, der udgør ca. 0,2 procent af serumantistofferne, eller ca. 1 ud af 500. Det er en monomer og har to epitop-bindende steder.
IgD findes bundet til overfladen af B-lymfocytter som en B-celle-receptor (også kaldet sIg), hvor det antages at kontrollere B-lymfocytaktivering og -undertrykkelse som respons på signaler fra immumoglobuliner, der cirkulerer i blodplasma. IgD kan være en faktor i den aktive eliminering af B-lymfocytter ved at generere selvreaktive auto-antistoffer. Selvom det forekommer nysgerrig, at antistoffer nogensinde vil angribe de celler, der fremstiller dem, kan denne eliminering undertiden kontrollere en overdrevent eller forkert orienteret immunrespons eller tage B-celler ud af puljen, når de er beskadiget og ikke længere syntetisere nyttige produkter.
Ud over sin rolle som en de facto celleoverfladeceptor findes IgD i mindre grad i blod og lymfevæske. Det er også hos nogle mennesker, at de reagerer med visse haptener (antigene underenheder) på penicillin, hvilket sandsynligvis er grunden til, at nogle mennesker er allergiske over for dette antibiotikum; det kan også reagere med almindelige, ufarlige blodproteiner på samme måde og derved påvirke en autoimmun respons.
IgE
IgE tegner sig kun for ca. 0,002 procent af serumantistof, eller ca. 1 / 50.000.del af alle cirkulerende immunoglobuliner. Ikke desto mindre spiller det en vigtig rolle i immunresponsen.
Ligesom IgD er IgE en monomer og har to antigene bindingssteder, et på hver "arm". Det har en kort halveringstid på to dage. Det er bundet til mastceller og basofiler, der cirkulerer i blod. Som sådan er det en mægler af allergiske reaktioner. Når et antigen binder til Fab-delen af et IgE-molekyle bundet til en mastcelle, får dette mastcellen til at frigive histamin i blodbanen. IgE deltager også i lysering eller kemisk nedbrydning af parasitter af den protosoiske sort (tænk amøber og andre unicellulære eller multicellulære indtrængende). IgE fremstilles også som respons på tilstedeværelsen af helminths (parasitiske orme) og visse leddyr.
Til tider spiller IgE også en indirekte rolle i immunresponsen ved at galvanisere andre immunkomponenter til handling. IgE kan beskytte slimhindeoverflader ved at påbegynde betændelse. Du tror måske, at betændelse betyder noget uønsket, da det har tendens til at forårsage smerter og hævelse. Men betændelse, blandt mange af dens andre immunfordele, gør det muligt for IgG, som er proteiner fra komplementveje, og hvide blodlegemer at komme ind i væv for at konfrontere indtrængende.
IgG
IgG er det dominerende antistof i den menneskelige krop, der tegner sig for hele 85 procent af alle immunoglobuliner. En del af dette skyldes den lange, omend variable halveringstid på syv til 23 dage, afhængigt af den pågældende IgG-underklasse.
Ligesom tre af de fem typer immunoglobulin eksisterer IgG som en monomer. Det findes hovedsageligt i blodet og lymfen. Det har den unikke evne til at krydse placenta hos gravide kvinder, hvilket tillader det at beskytte det ufødte foster og det nyfødte barn. Dets vigtigste aktiviteter inkluderer forbedring af fagocytose i makrofager (specialiserede "eater" -celler) og neutrofiler (en anden type hvide blodlegemer); neutraliserende toksiner; og inaktivere vira og dræbe bakterier. Dette giver IgG en bred palet af funktioner, der passer til et antistof, der er så udbredt i systemet. Det er normalt det andet antistof på scenen, når en invaderer er til stede, efter tæt bag IgM. Dens tilstedeværelse øges enormt i kroppens anamnestiske respons. "Anamnestic" betyder "ikke at glemme", og IgM reagerer på en invader, som den tidligere har stødt på med en øjeblikkelig stigning i sine tal. Endelig kan Fc-delen af IgG binde til NK-celler for at sætte i gang en proces kaldet antistofafhængig celleformidlet cytotoksicitet eller ADCC, som kan dræbe eller begrænse virkningerne af invaderende mikrober.
IgM
IgM er kolonnen af immunoglobuliner. Det findes som en pentameter eller en gruppe af fem bundne IgM-monomerer. IgM har en kort halveringstid (ca. fem dage) og udgør cirka 13 til 15 procent af serumantistoffer. Det er vigtigt, at det også er den første forsvarslinie blandt dens fire antistofsøskende, idet den er den første immunoglobulin, der er lavet under en typisk immunologisk respons.
Fordi IgM er en pentamer, har det 10 epitop-bindende steder, hvilket gør det til en hård modstander. Dens fem Fc-portioner, ligesom dem med de fleste andre immunoglobuliner, kan aktivere komplementproteinvejen, og som en "first responder" er den mest effektive type antistof i denne henseende. IgM agglutinerer invaderende materiale, hvilket tvinger individuelle stykker til at klæbe sammen for lettere at rydde fra kroppen. Det fremmer også lysering og fagocytose af mikroorganismer med en særlig affinitet til udstødning af bakterier.
Monomeriske former for IgM findes og findes hovedsageligt på overfladen af B-lymfocytter som receptorer eller sIg (som med IgD). Interessant nok har kroppen allerede produceret voksne niveauer af IgM i en alder af ni måneder.
En note om antistofdiversitet
Takket være den meget høje variation i den hypervariable del af Fab-komponenten i hver af de fem immunoglobuliner, kan der oprettes et astronomisk antal unikke antistoffer på tværs af de fem formelle klasser. Dette forstærkes af det faktum, at L- og H-kæderne også findes i en række isotyper, eller kæder, der er overfladisk ens i arrangement, men indeholder forskellige aminosyrer. Faktisk er der 45 forskellige gener "kappa" L-kæder, 34 "lambda" L-kæde gener og 90 H kæde gener i alt 177, hvilket igen giver mere end tre millioner unikke kombinationer af gener.
Dette giver mening set ud fra udviklingen og overlevelsens synspunkt. Ikke alene skal immunsystemet være parat til at konfrontere indtrængende, det allerede "kender" til, men det må også være parat til at skabe et optimalt svar på indtrængende, det aldrig har set, eller for den sags skyld, der er helt nye i den art, sådan som influenzavirus, der har udviklet sig selv gennem mutationer. Værten-indtrængende interaktion over tid og på tværs af mikrobielle arter og hvirveldyrarter er virkelig ikke mere end en igangværende, uendelig "våbenløb."