De fleste mennesker kender brugen af ord til numeriske værdier som "dusin" for tolv og "par" til to. Kemi anvender et lignende koncept med muldvarpen (forkortet mol), der ikke henviser til et lille gravende pattedyr, men til tallet 6.022 x 10 til den 23. magt. Antallet er langt mere præcist end det, men for de fleste beregninger er dette tilstrækkeligt nøjagtigt. Mole er afledt af antallet af atomer i 12 gram carbon-12, hvilket gør det muligt at anvende molekylvægten af et stof som en konverteringsfaktor mellem mol og gram af et stof.
Skriv formlen for stoffet med antallet af mol. Kemiske formler beskriver antallet af atomer for hvert element i et stof. For eksempel har vand formlen H2O, der indikerer, at hvert molekyle indeholder to atomer af hydrogen og et atom af ilt. Antallet af mol for hvert stof skrives inden formlen med værdier på en mol, der ikke er skrevet. To mol vand er skrevet som 2 H2O og 1,8 mol vand er skrevet som 1,8 mol H2O.
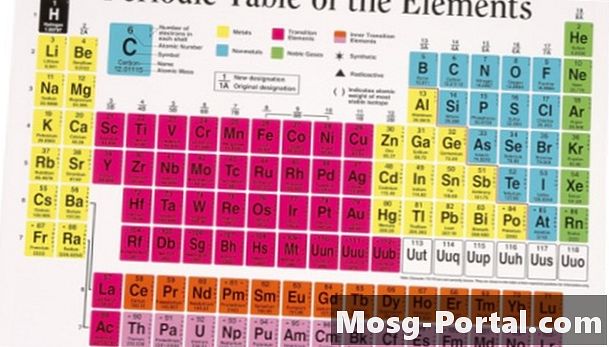
Samlede atomvægte for hvert atom i molekylet for at finde stoffets molekylvægt. Atomvægte er anført i den periodiske tabel nedenfor symbolet for hvert element. F.eks. Findes molekylvægten af vand ved at tilføje atomvægtene for de to hydrogenatomer og et oxygenatom i hvert molekyle. Den atomære vægt af brint er 1,008 og atomvægten for ilt er 16,00, så molekylvægten er 18,02 (1,008 + 1,008 + 16,00 = 18,02).
Multiplicer molekylvægten med antallet af mol for stoffet. Molekylvægten er antallet af gram pr. Mol for stoffet og giver omdannelsesfaktoren for mol til gram for det pågældende stof. Så en mol vand har en masse på 18,02 gram (1 mol H20 x 18,02 g / mol = 18,02 g). To mol vand har en masse på 36,04 gram (2 mol H20 x 18,02 g / mol = 36,02 g). Fraktioner af en mol beregnes på samme måde, så 1,8 mol vand har en masse på 32,44 g (1,8 mol H20 x 18,02 g / mol = 32,44 g).