Indhold
I en kemisk reaktion omdannes udgangsmaterialerne, kaldet reaktanter, til produkter. Mens alle kemiske reaktioner kræver en indledende energiindgang, benævnt aktiveringsenergi, resulterer nogle reaktioner i en nettofrigivelse af energi i omgivelserne, og andre resulterer i en nettoabsorption af energi fra omgivelserne. Den sidstnævnte situation kaldes en endergonic reaktion.
Reaktionsenergi
Kemikere definerer deres reaktionskar som ”systemet” og alt andet i universet som ”omgivelserne”. Derfor, når en endergonic reaktion absorberer energi fra omgivelserne, kommer energien ind i systemet. Den modsatte type er en eksergonisk reaktion, hvor energi frigøres i omgivelserne.
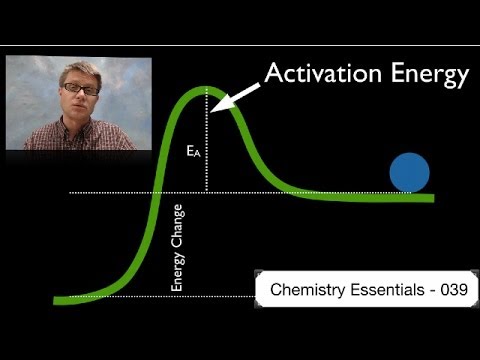
Den første del af enhver reaktion kræver altid energi, uanset reaktionstype. Selvom brændende træ afgiver varme og spontant forekommer, når det først kommer i gang, er du nødt til at starte processen ved at tilføje energi. Flammen, du tilføjer for at starte træbrændingen, giver aktiveringsenergien.
Aktiveringsenergi
For at komme fra reaktantsiden til produktsiden af den kemiske ligning skal du overvinde aktiveringsenergibarrieren. Hver individuelle reaktion har en karakteristisk barriere-størrelse. Barrierens højde har intet at gøre med, om reaktionen er endergonic eller exergonic; for eksempel kan en exergonisk reaktion have en meget høj aktiveringsenergibarriere eller omvendt.
Nogle reaktioner finder sted i flere trin, hvor hvert trin har sin egen aktiveringsenergibarriere til at overvinde.
eksempler
Syntetiske reaktioner har en tendens til at være endergoniske, og reaktioner, der nedbryder molekyler, har en tendens til at være eksergoniske. For eksempel er processen med aminosyrer, der slutter sig til at fremstille et protein, og dannelsen af glukose fra kuldioxid under fotosyntesen begge endergoniske reaktioner. Dette giver mening, da processer, der bygger større strukturer sandsynligvis kræver energi. Den modsatte reaktion - for eksempel cellulær respiration af glukose i kuldioxid og vand - er en exergonisk proces.
Katalysatorer
Katalysatorer kan reducere aktiveringsenergibarrieren ved en reaktion. Det gør de ved at stabilisere den mellemliggende struktur, der findes mellem reaktantens og produktmolekylernes struktur, hvilket gør omdannelsen lettere. Grundlæggende giver katalysatoren reaktanterne en "energi" med lavere energi at passere igennem, hvilket gør det lettere at komme til produktsiden af aktiveringsenergibarrieren. Der er mange typer katalysatorer, men nogle af de bedst kendte er enzymer, katalysatorer i biologiens verden.
Reaktionsspontanitet
Uanset aktiveringsenergibarriere forekommer kun exergoniske reaktioner spontant, fordi de afgiver energi. Alligevel er vi stadig nødt til at opbygge muskler og reparere vores kroppe, som begge er endergonic processer. Vi kan køre en endergonic proces ved at koble den til en eksergonisk proces, der giver energi nok til at matche forskellen i energi mellem reaktanter og produkter.