Indhold
For blot at beregne deres beregninger skabte kemikere en standardenhed for antallet af atomer i en bestemt forbindelse involveret i en reaktion eller en anden kemisk proces. De definerer en mol (mol) som mængden af ethvert stof, der har det samme antal grundlæggende enheder som 12 gram carbon-12, hvilket er Avogadros-nummer (6.022 × 1023). SI (metrisk) målesystem definerer en millimol (Mmol) som en tusindedel af en mol. Du beregner normalt antallet af mol af et stof ved at veje den mængde, du har til rådighed. Hvis du vil konvertere til Mmol, skal du multiplicere med 103 (1,000).
TL; DR (for lang; læste ikke)
En mol er lig med Avogadros-antallet af partikler i en bestemt forbindelse. En millimol (Mmol) er en tusindedel af en mol.
Sådan beregnes mol
Atommasser måles i atommasseenheder (AMU). Én AMU er nøjagtigt 1/12 massen af kernen i et carbon-12 atom i dets jordtilstand. En mol af et stof defineres som lig med Avogadros-antallet af partikler af dette stof. I henhold til denne definition er vægten af en mol af et stof i gram det samme antal som vægten af en individuel partikel af det pågældende stof i AMU. For eksempel er atomvægten af carbon-12 12 AMU, så en mol carbon-12 vejer 12 gram.
Overvej en beholder fuld af brintgas (H2). Hver partikel i beholderen er et molekyle bestående af to hydrogenatomer, så du behøver kun at kende den atomære masse af brint for at beregne molekylvægten. De fleste versioner af den periodiske tabel viser atommassen for hvert element under dets symbol. For brint, der har en enkelt proton i sin kerne, er dens 1.008 AMU, som er et gennemsnit af alle de naturligt forekommende isotoper af brint. Følgelig er den atomære masse af brintgas 2,016 AMU, og en mol brintgas vejer 2,016 gram. For at finde antallet af mol i din prøve ville du veje prøven i gram og dele den vægt med molekylvægten af brintgas i gram. For eksempel indeholder en prøve, der vejer 15 gram ren brintgas, 7,44 mol.
Konvertering til Mmol
Undertiden er mængder, der undersøges, så små, at det er besværligt at udtrykke dem i mol. Indtast millimolen. Ved at multiplicere antallet af mol med tusind kan du konvertere et meget lille antal til et mere håndterbart. Dette er især praktisk, når man håndterer volumenheder i størrelsesordenen milliliter.
1 mol = 1.000 Mmol
Opløsningskoncentration
Kemikere bruger molaritet som et mål for koncentration af en bestemt forbindelse i opløsning. De definerer molaritet som antallet af mol pr. Liter. Du konverterer molaritet til millimolaritet ved at multiplicere med 1.000. For eksempel har en 1 mol (molær, også skrevet som M) opløsning en koncentration på 1 mol pr. Liter. Dette svarer til en 1.000 Mmol (millimolar, også undertiden skrevet som mM), som er en, der indeholder 1.000 Mmol pr. Liter.
Eksempel
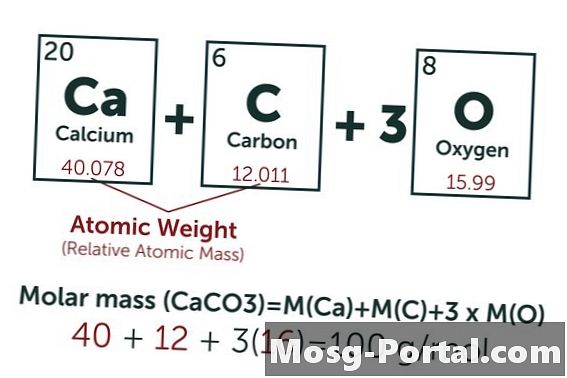
En opløsning indeholder 0,15 gram calciumcarbonat. Hvor mange millimol er det?
Den kemiske formel for calciumcarbonat er CaCO3. Den atomære vægt af carbon (C) er ca. 12 AMU, vægten af ilt (O) ca. 16 AMU og vægten af calcium (Ca) ca. 40 AMU. Hvert molekyle af calciumcarbonat vejer således 100 AMU, hvilket betyder, at en mol vejer cirka 100 gram. En vægt på 0,15 gram repræsenterer 0,15 g ÷ 100 g / mol = 0,0015 mol. Dette svarer til 1,5 Mmol.
Hvad er molariteten og millimolariteten af dette meget calciumcarbonat i 2,5 liter opløsning?
Molaritet er defineret som antallet af mol pr. Liter, så del antallet af mol med 2,5 for at få molariteten: 0,0015 ÷ 2,5 =
0,0006 M
Multiplicer med 1.000 for at få millimolaritet =
0,6 mM
Bemærk, at du når frem til det samme resultat for millimolaritet, hvis du deler antallet af millimol med volumen af opløsning.