Atomer består af en tæt kerne eller kerne, der indeholder positivt ladede partikler kaldet protoner og uladede partikler kaldet neutroner. Negativt ladede elektroner optager noget begrænsede områder af rummet uden for kernen kaldet orbitaler. Protoner og neutroner vejer næsten 2.000 gange mere end elektroner og repræsenterer derfor næsten hele atomens masse. For ethvert givet element i den periodiske tabel er antallet af protoner i atomernes kerner konstant. Hvert carbonatom, for eksempel, indeholder seks elektroner. Antallet af elektroner matcher antallet af protoner i et neutralt atom, men atomer kan vinde eller miste elektroner under kemiske reaktioner. Antallet af neutroner varierer også fra et atom til det næste. Kemikere henviser til atomer af det samme element med forskellige antallet af neutroner som isotoper. At forstå disse udtryk repræsenterer nøglen til bestemmelse af protoner, neutroner og elektroner i en isotop.
Identificer isotopets massenummer fra dens symbol. Efter konvention angiver forskere massen af en isotop som et påskrift nummer foran det elementære symbol, såsom 235U, eller med en bindestreg efter symbolet, som i U-235.
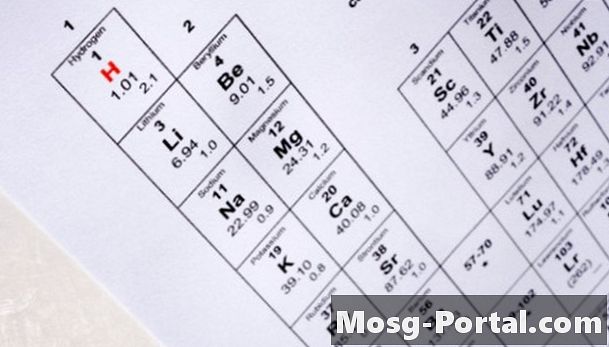
Bestemm antallet af protoner i isotopens kerne ved at placere dets atomnummer på det periodiske bord for elementerne. Den periodiske tabel arrangerer elementer ved at øge atomantallet. U repræsenterer for eksempel det kemiske symbol for uran, og det har et atomnummer på 92. Dette betyder, at alle uranatomer indeholder 92 protoner i deres kerne.
Beregn antallet af elektroner, der er indeholdt af isotopen, ved at bemærke, om dens symbol inkluderer en ladning. Ladningsnotationen repræsenterer enten et positivt eller negativt tal, normalt skrevet som et påskrift efter det kemiske symbol, såsom 235U (4+). Dette indikerer, at uranatom har mistet fire elektroner. I fravær af en angivet ladning har isotopen en ladning på nul, og dens antal elektroner er lig med antallet af protoner. Træk positive ladninger fra eller tilføj negative ladninger til atomnummeret, hvis symbolet indeholder en angivet ladning. For eksempel vil 235U (4+) indeholde 92 - 4 = 88 elektroner.
Find antallet af neutroner i isotopen ved at trække antallet af protoner fra massetallet, der er angivet i symbolet. For eksempel indeholder 235U, der indeholder 92 protoner, derfor 235 - 92 = 143 neutroner.