Indhold
- TL; DR (for lang; læste ikke)
- En aktiveringsenergidefinition
- Eksempler på kemiske reaktioner, der kræver aktiveringsenergi
Mens nogle kemiske reaktioner starter, så snart reaktanterne kommer i kontakt, reagerer kemikalierne for mange andre ikke, før de leveres med en ekstern energikilde, der kan give aktiveringsenergien. Der er flere grunde til, at reaktanter i nærheden muligvis ikke umiddelbart indgår i en kemisk reaktion, men det er vigtigt at vide, hvilke reaktionstyper der kræver en aktiveringsenergi, hvor meget energi der kræves, og hvilke reaktioner der fortsætter med det samme. Først da kan kemiske reaktioner påbegyndes og kontrolleres på en sikker måde.
TL; DR (for lang; læste ikke)
Aktiveringsenergi er den energi, der kræves for at starte en kemisk reaktion. Nogle reaktioner fortsætter med det samme, når reaktanterne samles, men for mange andre er det ikke nok at placere reaktanterne i nærheden. En ekstern energikilde til levering af aktiveringsenergien kræves for at reaktionen kan fortsætte.
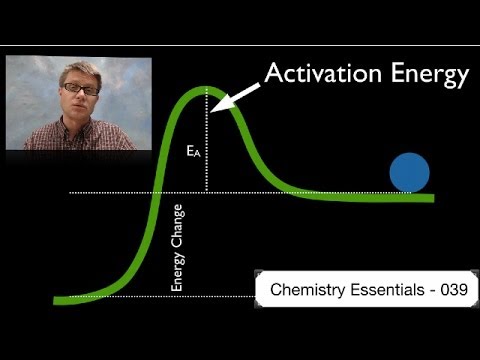
En aktiveringsenergidefinition
For at definere aktiveringsenergi skal initieringen af kemiske reaktioner analyseres. Sådanne reaktioner opstår, når molekyler udveksler elektroner, eller når ioner med modsatte ladninger samles. For at molekyler skal udveksle elektroner, skal de bindinger, der holder elektronerne bundet til et molekyle, brydes. For ioner har de positivt ladede ioner mistet en elektron. I begge tilfælde er der behov for energi til at bryde de indledende bindinger.
En ekstern energikilde kan give den energi, der kræves for at fjerne de pågældende elektroner og lade den kemiske reaktion fortsætte. Aktiveringsenergienheder er enheder som kilojoules, kilokalorier eller kilowattimer. Når reaktionen er i gang, frigiver den energi og er selvbærende. Aktiveringsenergien kræves kun i begyndelsen for at lade den kemiske reaktion starte.
Baseret på denne analyse defineres aktiveringsenergi som den minimale energi, der kræves for at starte en kemisk reaktion. Når der tilføres energi til reaktanter fra en ekstern kilde, accelererer molekylerne og kolliderer mere voldsomt. De voldelige kollisioner slipper elektroner fri, og de resulterende atomer eller ioner reagerer med hinanden for at frigive energi og holde reaktionen i gang.
Eksempler på kemiske reaktioner, der kræver aktiveringsenergi
Den mest almindelige type reaktion, der kræver aktiveringsenergi, involverer mange slags ild eller forbrænding. Disse reaktioner kombinerer ilt med et materiale, der indeholder kulstof. Kulstofet har eksisterende molekylære bindinger med andre elementer i brændstoffet, medens iltgas eksisterer som to oxygenatomer bundet sammen. Kulstof og ilt reagerer normalt ikke med hinanden, fordi de eksisterende molekylære bindinger er for stærke til at blive brudt af almindelige molekylære kollisioner. Når ekstern energi, såsom en flamme fra en fyrstik eller en gnist bryder nogle af bindingerne, reagerer de resulterende ilt- og kulstofatomer for at frigive energi og holde en ild i gang, indtil den løber tør for brændstof.
Et andet eksempel er brint og ilt, der danner en eksplosiv blanding. Hvis brint og ilt blandes sammen ved stuetemperatur, sker der ikke noget. Både brint og iltgas består af molekyler med to atomer bundet sammen. Så snart nogle af disse bindinger er brudt, for eksempel af en gnist, resulterer en eksplosion. Gnisten giver et par molekyler ekstra energi, så de bevæger sig hurtigere og kolliderer og bryder deres bindinger. Nogle ilt- og brintatomer samles og danner vandmolekyler og frigiver en stor mængde energi. Denne energi fremskynder flere molekyler, bryder flere bindinger og lader flere atomer reagere, hvilket resulterer i eksplosionen.
Aktiveringsenergi er et nyttigt koncept, når det kommer til at igangsætte og kontrollere kemiske reaktioner. Hvis en reaktion kræver aktiveringsenergi, kan reaktanterne opbevares sikkert sammen, og den tilsvarende reaktion finder ikke sted, før aktiveringsenergien leveres fra en ekstern kilde. Ved kemiske reaktioner, som ikke har brug for en aktiveringsenergi, f.eks. Metallisk natrium og vand, skal reaktanterne opbevares omhyggeligt, så de ikke kommer i kontakt med et tilfælde og forårsager en ukontrolleret reaktion.